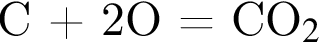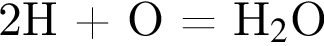Катионом является частица, формула которой:
Число нейтронов в составе атома ![]() равно:
равно:
Электронная конфигурация 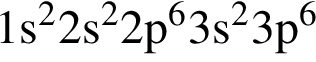 соответствует иону или атому в основном состоянии:
соответствует иону или атому в основном состоянии:
Согласно положению в периодической системе наибольшее значение электроотрицательности имеет химический элемент с порядковым номером:
Охарактеризуйте химическую связь в молекуле кислорода:
а) ковалентная неполярная
б) ковалентная полярная
в) одинарная
г) кратная
В кристалле 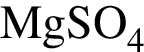 присутствуют связи:
присутствуют связи:
Укажите ряд, в котором оба гидроксида можно получить растворением соответствующего металла в воде:
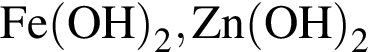
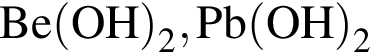
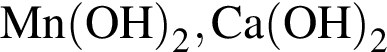
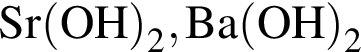
Литий массой 3,50 г растворили в воде массой 90,0 г. Массовая доля (%) вещества в полученном растворе равна:
Карбонат кальция массой 10,0 г полностью растворили в избытке соляной кислоты массой 300 г. Масса (г) образовавшегося раствора после завершения реакции составляет (растворимостью выделяющегося газа пренебречь):
Для получения железа из водного раствора хлорида железа(II) целесообразно использовать металл:
Масса твердого остатка будет наибольшей при термическом разложении соли химическим количеством 1 моль, формула которой:
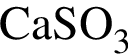
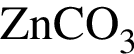
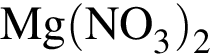

Газ выделяется при добавлении избытка разбавленной серной кислоты к веществам:
а) ![]()
б) 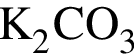
в) 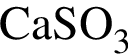
г) 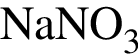
В разбавленном водном растворе с сульфатом аммония при 20 °C реагируют вещества:
а) ![]()
б) ![]()
в) ![]()
г) ![]()
Укажите НЕПРАВИЛЬНОЕ утверждение:
Число веществ из предложенных — 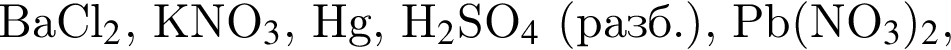 которые реагируют (20 °C) с раствором сульфата натрия, равно:
которые реагируют (20 °C) с раствором сульфата натрия, равно:
Разбавленная фосфорная кислота вступает в реакции соединения с веществами
а) Ca(OH)2
б) Na3PO4
в) NH3
г) KCl
Избыток газа, полученного действием серной кислоты на известняк, пропускают в стакан с известковой водой. При этом в стакане:
Для получения стекла состава 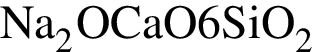 используют сырье, содержащее все вещества ряда:
используют сырье, содержащее все вещества ряда:
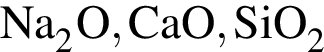
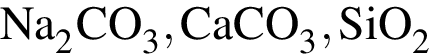
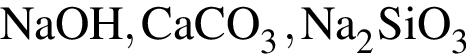
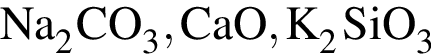
Только окислительные свойства в химических реакциях может проявлять вещество, формула которого (возможность окисления ![]() не учитывайте):
не учитывайте):
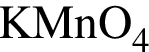
К раствору серной кислоты добавили алюминий массой 9г. В результате реакции массовая доля кислоты в растворе снизилась от 28% до 21%. Масса (г) исходного раствора:
В закрытой системе протекает одностадийное превращение
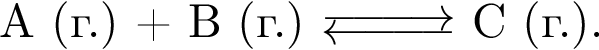
После установления равновесия давление в системе увеличили в три раза.
Укажите правильное утверждение:
В закрытом сосуде постоянного объема протекает обратимая химическая реакция:

Повышение температуры в сосуде приводит к:
а) смещению равновесия в сторону исходных веществ;
б) увеличению скорости обратной реакции;
в) уменьшению скорости обратной реакции;
г) повышению давления.
При уменьшении давления в 4 раза при постоянной температуре в равновесной системе
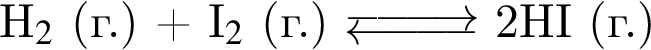 :
:
При охлаждении насыщенного водного раствора ![]() до
до ![]() С в стакане выпал осадок. Укажите правильное утверждение:
С в стакане выпал осадок. Укажите правильное утверждение:
К увеличению ![]() водного раствора приведет:
водного раствора приведет:
При добавлении к воде оксида кальция:
а) рН увеличивается;
б) рН уменьшается;
в) концентрация ионов ![]() НЕ изменяется;
НЕ изменяется;
г) концентрация ионов ![]() уменьшается.
уменьшается.
Изомером бутановой кислоты является вещество, формула которого:
Для алюминия характерно:
а) высшая степень окисления в соединениях равна +3
б) в промышленности получают методом электролиза
в) в реакции с йодом катализатором является вода
г) НЕ реагирует с растворами щелочей
Выберите вещества, которые в указанных условиях реагируют с бензолом:
а — 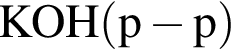
б — 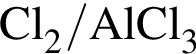
в — 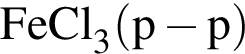
г — 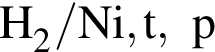
Сумма коэффициентов в уравнении химической реакции полного сгорания гексана равна:
В результате реакции 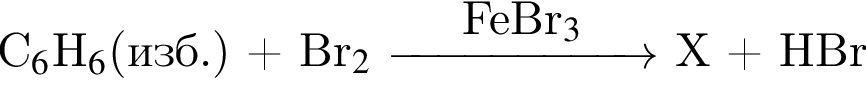
получен бромоводород количеством 0,7 моль. Масса (г) органического продукта Х составляет:
Фенол в отличие от этанола:
В результате окисления альдегида аммиачным раствором оксида серебра(I) получена соответствующая кислота. При взаимодействии кислоты с метанолом в условиях кислотного катализа образовался сложный эфир состава 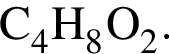 Укажите название альдегида:
Укажите название альдегида:
Строение карбоксильной группы верно отражено на рисунке:
В схеме превращений образуются:
Укажите формулу глюкозы:
Сумма коэффициентов в уравнении реакции полного окисления глутаминовой кислоты кислородом равна:
Выберите утверждение, верно характеризующее высокомолекулярное соединение, формула которого представлена на рисунке:
Аминоуксусная кислота взаимодействует с веществами, формулы которых (электролиты взяты в виде водных растворов):
а) ![]()
б) ![]()
в) ![]()
г) ![]()
Укажите реагент, с помощью которого можно качественно отличить раствор водный раствор диметиламина от водного раствора метаналя
1) раствор хлорида бария
2) известковая вода
3) лакмус
4) раствор гидроксида бария
Для получения веществ по указанной схеме превращений
![]() →
→ ![]() →
→ ![]() →
→ ![]() →
→ ![]()
выберите реагенты из предложенных:
1 — ![]()
2 — ![]()
3 — 
4 — ![]()
5 — ![]()
Ответ запишите цифрами в порядке следования превращений, например: 1224. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
Смесь алканов подвергли пиролизу. В результате образовалась смесь этена, пропена и водорода с массовой долей водорода 1,96%. Вычислите молярную массу (г/моль) исходной смести алканов.
Установите соответствие между структурной формулой органического вещества и общей формулой гомологического ряда, к которому относится это вещество.
А)
Б)
В)
Г)
гомологического ряда
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б3В5Г1.
К раствору сульфата меди (II) массой 400 г с массовой долей CuSO4 8%добавили медный купорос массой 40 г и перемешали смесь до полного его растворения. Рассчитайте массовую долю (%) соли в полученном растворе.
При упаривании раствора исходной массой 250 г массовая доля соли в нем увеличилась в 1,25 раза. К полученному раствору добавили эту же соль массой 40 г, которая полностью растворилась, а массовая доля соли в растворе стала равной 30%. Вычислите массовую долю (%) соли в исходном растворе.
При дегидратации насыщенного ациклического одноатомного спирта образовался алкен, объем паров которого в 12 раз меньше объема кислорода, необходимого для полного сгорания такой же порции спирта. Рассчитайте молярную массу (г/моль) спирта (объемы веществ измерены при одинаковых условиях).
Определите сумму молярных масс (г/моль) азотсодержащих веществ ![]() и
и ![]() образовавшихся в результате превращений, протекающих по схеме (
образовавшихся в результате превращений, протекающих по схеме (![]() — вещество немолекулярного строения,
— вещество немолекулярного строения, ![]() — молекулярного строения)
— молекулярного строения)
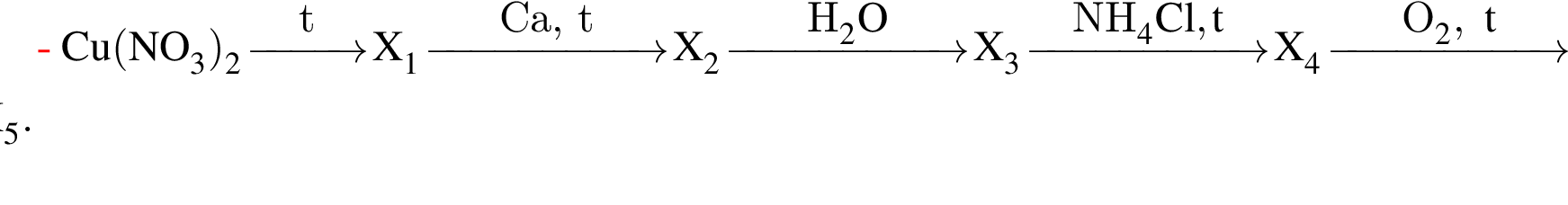
Дана схема превращений
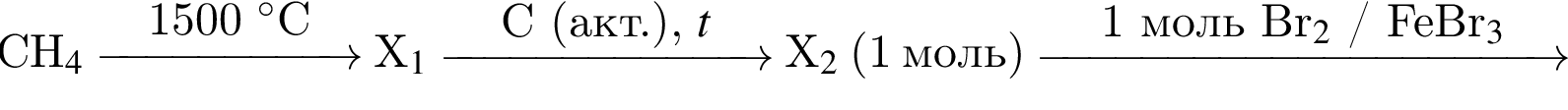
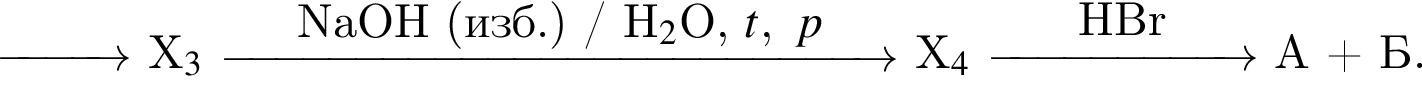
Определите сумму молярных масс (г/моль) органического и неорганического веществ А и Б.
В результате поджигания смеси объемом (н. у.) 800дм3, состоящей из сероводорода, взятого в избытке, и кислорода, образовались сера и вода. После приведения полученной смеси к нормальным условиям в газообразном состоянии остался только сероводород объемом 200дм3. Рассчитайте объемную долю (%) кислорода в исходной смеси.
В смеси, состоящей из пропена, диметиламина и бутина-1, массовые доли углерода и водорода равны 82,5% и 12,7% соответственно. Вычислите максимальную массу (г) такой смеси, которую можно окислить газовой смесью массой 222,4 г, состоящей из озона и кислорода. Продуктами реакции являются только  и
и ![]()

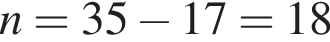
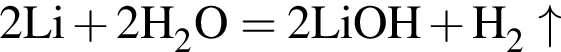
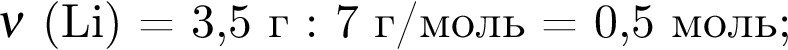
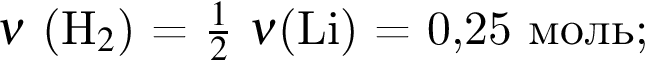
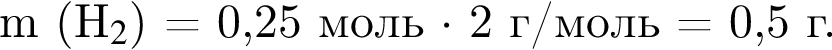
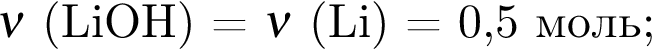
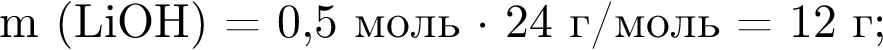
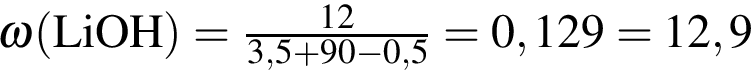 %.
%.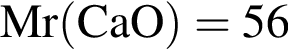 г/моль,
г/моль, 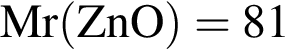 г/моль
г/моль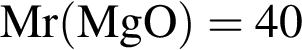 г/моль
г/моль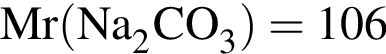 г/моль, однако из 1 моль гидрокарбоната образуется 0,5 моль продукта. Следовательно, масса остатка составит 53 г.
г/моль, однако из 1 моль гидрокарбоната образуется 0,5 моль продукта. Следовательно, масса остатка составит 53 г.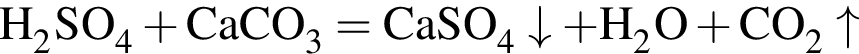
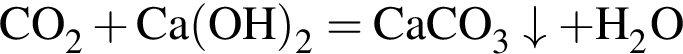
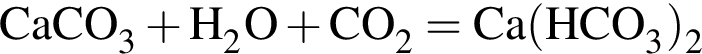
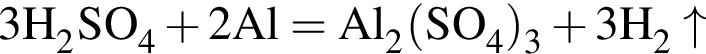
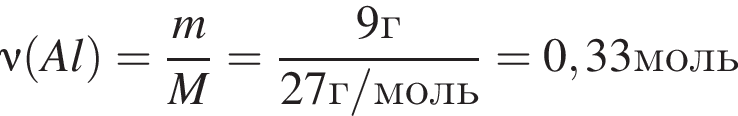
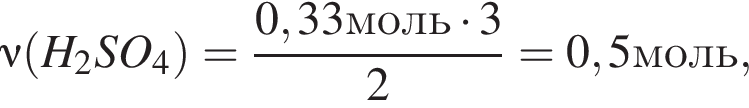 откуда
откуда 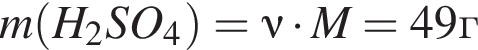 и
и 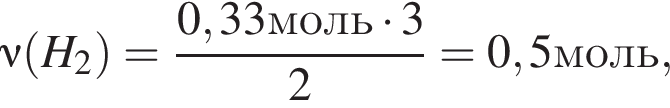 откуда
откуда 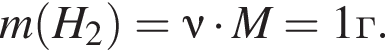
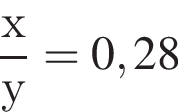
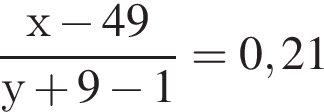

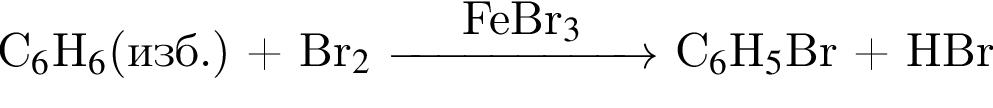
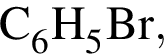 учитывая стехиометрические коэффициенты уравнения реакции, очевидно, что:
учитывая стехиометрические коэффициенты уравнения реакции, очевидно, что:

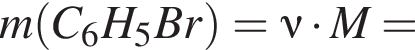
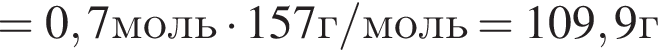

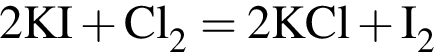
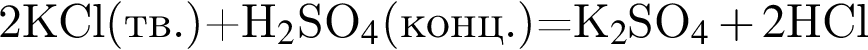
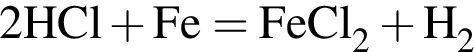
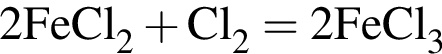
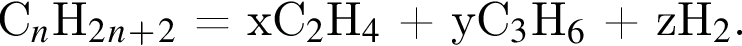
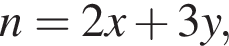 число атомов водорода
число атомов водорода 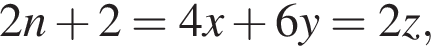 получим
получим 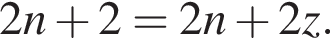 Значит, z = 1.
Значит, z = 1.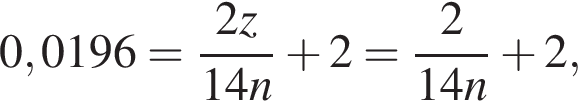
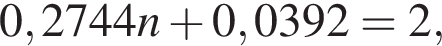 откуда n = 7,15 — среднее значение.
откуда n = 7,15 — среднее значение.
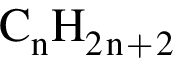 . Наличие двойной связи или цикла отнимают два атома водорода. Тройная связь отнимает 4 атома водорода.
. Наличие двойной связи или цикла отнимают два атома водорода. Тройная связь отнимает 4 атома водорода.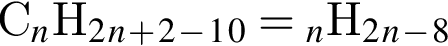 Ответ: 6).
Ответ: 6).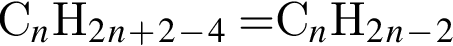 Ответ: 3).
Ответ: 3).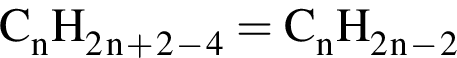 Ответ: 3)
Ответ: 3)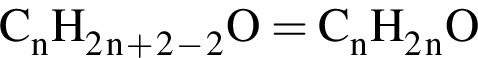 Ответ 8)
Ответ 8)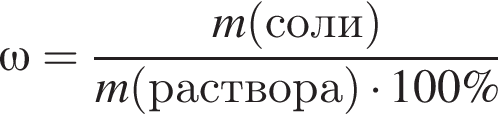
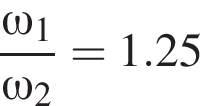
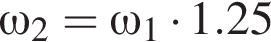
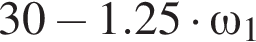 частей чистой соли и 70 частей раствора после упаривания, чтобы получился 30% раствор. Составив пропорцию получаем, что
частей чистой соли и 70 частей раствора после упаривания, чтобы получился 30% раствор. Составив пропорцию получаем, что 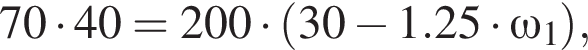 тогда
тогда 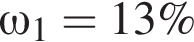
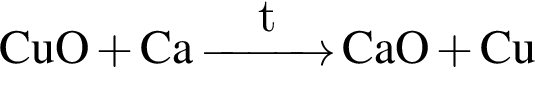

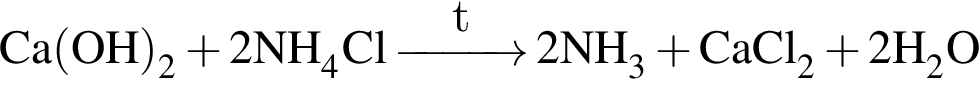
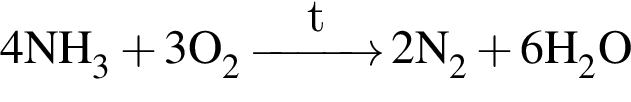
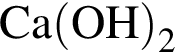
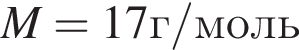
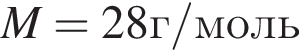
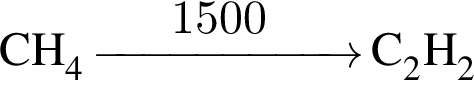 ацетилен (алкин)
ацетилен (алкин)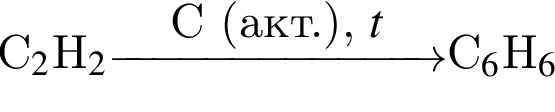 Бензол
Бензол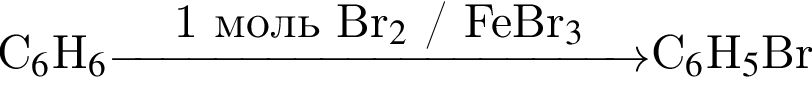 Бромбензол
Бромбензол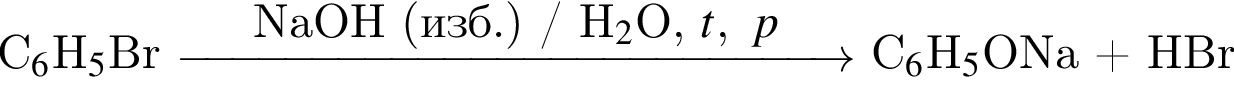 Фенолят натрия
Фенолят натрия 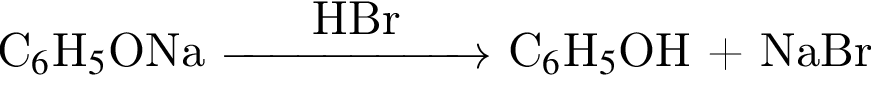 Фенол + бромид натрия
Фенол + бромид натрия
 т. е. V(
т. е. V(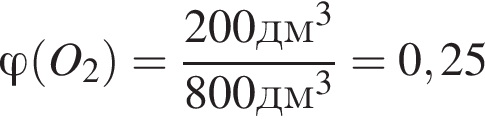 (25%).
(25%).